中国科学院国家纳米科学与技术中心(NCNST)陈春英教授领导的一个研究小组最近研究了内吞过程中纳米蛋白冠的演变及其对蛋白质稳态和细胞的干扰。代谢。他们的结果发表在PNAS上。
当纳米粒子进入生物系统时,生物体液中的生物分子迅速与纳米粒子表面结合。作为起始步骤,与血液中的蛋白质分子相互作用形成的纳米蛋白冠对纳米颗粒的运输和命运有着巨大的影响。纳米蛋白冠的形成如何影响纳米粒子在不同屏障系统的组织和细胞中的识别、转运、分布、功能和生物学效应,是纳米材料医学应用的“黑匣子”,不仅限制了其递送纳米药物的效率,也严重影响疗效和安全性。
该领域的一个重要挑战是纳米蛋白冠的复杂性,它受到不同组织和器官中生物分子的多样性以及生理和病理状态的影响。目前,迫切需要了解蛋白质冠的蛋白质组成和结构特征如何在生物微环境中进化。
为解决这一问题,研究人员通过多维多组学(蛋白质组学、代谢组学、脂质组学)、分子间相互作用的创新应用,揭示了纳米蛋白冠的蛋白质组成在细胞转运过程中的动态演化模式。和原位质谱成像。
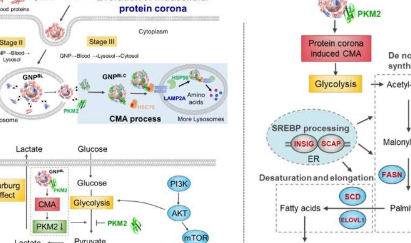
以金纳米粒子为模型,研究了蛋白质电晕从血液系统到细胞内(血液-溶酶体-细胞质)的动态演化过程。当纳米粒子从血液环境被内吞到溶酶体中,然后从溶酶体逃逸到细胞质中时,纳米粒子表面的蛋白质组成会发生巨大变化。大多数被细胞内蛋白质分子取代,只保留了血液环境中形成的部分蛋白质冠状成分。
随后,纳米蛋白冠的细胞内进化不仅破坏了细胞内蛋白质稳态(proteostasis),还引发了伴侣蛋白(HSC70、HSP90)和丙酮酸激酶M2(PKM2)在细胞内纳米冠表面的富集,并刺激伴侣介导的自噬。它进一步影响细胞糖酵解,引起细胞能量代谢的改变,调节细胞脂质代谢过程。
该研究阐明了纳米颗粒从血液到亚细胞微环境的进化模式,并确定了纳米蛋白冠细胞内微环境的特异性,从而重塑了细胞代谢。也为深入理解纳米材料的复杂生物学效应和纳米生物界面调控提供了理论支持。