随着抗生素耐药性感染的增加和不断演变的大流行病毒,很容易理解为什么研究人员希望能够设计出可以关闭这些感染的工程纳米粒子。密歇根大学开发的一种新的机器学习模型可以预测纳米颗粒和蛋白质之间的相互作用,让我们离这一现实更近了一步。
“我们将纳米粒子重新构想为不仅仅是药物输送载体。我们认为它们本身就是活性药物,”急诊医学助理教授、自然计算科学研究的作者J.ScottVanEpps说。
发现药物是一个缓慢且不可预测的过程,这就是为什么这么多抗生素是以前药物的变种。药物开发人员希望设计能够以他们选择的方式攻击细菌和病毒的药物,利用支配生物分子之间相互作用的“锁和钥匙”机制。但目前尚不清楚如何从使用纳米粒子破坏感染的抽象概念转变为概念的实际实施。
“通过将数学方法应用于蛋白质-蛋白质相互作用,我们简化了模拟这些蛋白质对中一种蛋白质的纳米粒子的设计,”IrvingLangmuir杰出大学化学科学与工程教授、该研究的通讯作者NicholasKotov说.
“纳米颗粒比生物分子更稳定,可以产生全新类别的抗菌和抗病毒药物。”
新的机器学习算法使用三种不同的方式将纳米粒子与蛋白质进行比较。虽然第一个是传统的化学描述,但与结构有关的两个对于预测纳米粒子是否会与特定蛋白质形成锁匙匹配是最重要的。
在它们之间,这两种结构描述捕捉到了蛋白质的复杂表面以及它如何重新配置自身以实现锁定和钥匙配合。这包括纳米颗粒可以放入的口袋,以及这种纳米颗粒需要的尺寸。描述还包括手性,即顺时针或逆时针扭转,这对于预测蛋白质和纳米粒子如何锁定很重要。
“我们可以针对细菌内外的许多蛋白质。我们可以使用这个模型作为第一次筛选,以发现哪些纳米粒子将与哪些蛋白质结合,”化学工程博士后研究员EmineSumeyraTuraliEmre说。该论文的作者,以及博士MinjeongCha。材料科学与工程专业的学生。
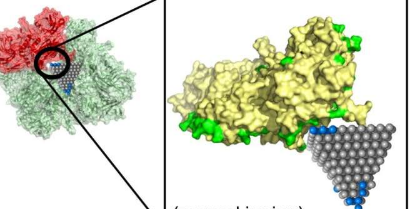
Emre和Cha解释说,研究人员可以通过更详细的模拟和实验来跟进他们的算法确定的匹配。一种这样的匹配可以阻止MRSA(一种常见的抗生素抗性菌株)的传播,使用氧化锌纳米锥体来阻断细菌中的代谢酶。
“像我们这样的机器学习算法将为可用于许多生物过程的纳米粒子提供设计工具。抑制导致COVID-19的病毒就是一个很好的例子,”Cha说。“我们可以使用这种算法有效地设计对所有变体具有广谱抗病毒活性的纳米颗粒。”
这一突破是由UM工程学院的蓝天计划促成的,该计划为跨学科团队提供了支持,该团队在纳米粒子的生物活性数据如此稀少的情况下,对机器学习方法是否有效进行了基本探索。
“BlueSky理念的核心正是这项工作所涵盖的内容:找到一种以统一的方法来表示蛋白质和纳米颗粒的方法,以理解和设计具有多种对抗细菌方式的新型药物,”安吉拉·维奥利(AngelaVioli)说,ArthurF.Thurnau教授,机械工程教授,纳米生物蓝天项目的负责人。
加州大学洛杉矶分校的合作者也为机器学习算法做出了贡献。