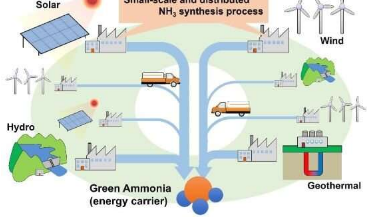
广岛大学日本科学家的研究揭示了一种在环境压力下从氮和氢的组成分子中制造氨的方法。这项新研究于 2 月 2 日发表在《物理化学杂志 C》上,展示了一种具有可再生能源储存和转移潜力的过程,该过程依赖于分散和波动的资源网络,例如太阳和风。“这项工作的最终目标是建立小规模的 NH 3生产工艺,以有效利用可再生能源,”研究作者、广岛大学自然科学基础研究与开发中心副教授 Hiroki Miyaoka 说。
氨(NH 3)最近被认为是一种出色的能量载体分子。1918 年,德国化学家弗里茨·哈伯 (Fritz Haber ) 因从其元素中合成氨而获得诺贝尔奖,这为氨在工业肥料中的重要作用铺平了道路。然而,氨在可再生能源应用中的使用受到可用于合成氨的工艺的限制。Haber-Bosch 工艺用于氨的工业生产,需要高温和高压,而这些条件在可再生能源储存和运输基础设施中通常不具备。
使用氢化锂 (LiH) 通过化学链合成NH 3的过程首先是在环境压力和高达 500°C 的温度下将 LiH 与 N 2 (分子氮)结合以产生酰亚胺锂产物 (LiNH 2 )。然后酰亚胺锂与氢气(H 2 )反应生成氨。在这个过程中由其组成分子合成氨的反应时间超过1000分钟。它的速度受到反应产物聚集(聚集)成大颗粒(超过 200 微米)的限制,这些颗粒没有太多的表面积暴露在氢气中。因其在分布式可再生能源中的实际应用,这种需要极端条件的长时间反应是氨生产的障碍。
在这项新研究中,研究人员尝试使用氧化锂 (Li 2 O) 作为分子支架,在环境压力和低于 400°C 的温度下合成氨,这些条件在非工业环境中很容易模拟。他们将反应物氢化锂与氧化锂结合起来,发现氢化锂可以防止结块,留下更小的颗粒(小于 50 微米),并有更多的表面积暴露在化学反应中。使用这些非聚集反应物并添加用于合成氨的最后一步的气态氢,他们能够更快地生产氨;反应大大加快了。
如果可以在适度的温度和压力条件下使用相对简单的设备快速生产氨,那么它为小规模的氨生产铺平了道路。
“化学循环工艺有助于建立小规模的NH 3合成工艺,与传统催化工艺相比,该工艺可以在更低的压力和温度下以更高的转化率运行,”Miyaoka 说。新工艺还消除了对用于工业合成氨的昂贵金属催化剂的需求,例如元素钌 (Ru)。
这项研究的结果与可再生能源发电有关,后者往往比工业生产更分散。广岛实验室率先在近乎环境条件下高效生产氨的工艺是此类应用的基础。